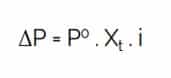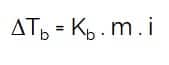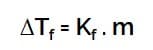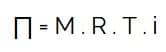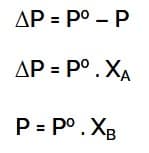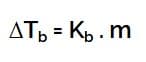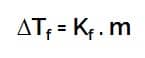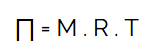Pada kesempatan kali ini pengajar.co.id akan membuat artikel yang berjudul Sifat koligatif larutan : pengertian , rumus dan contoh soal, yuk kita bahas bersama-sama dibawah ini.
Pengertian Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat yang tidak selalu tergantung pada zat terlarut, tetapi yang tergantung pada banyak partikel zat terlarut dan pelarut.
Sifat yang meliputi koligatif dapat diketahui dalam bentuk larutan pelarut dan pelarut memiliki sedikit efek pada sifat kimia zat terlarut dan pelarut.
Rumus Sifat Koligatif Larutan Elektrolit
-
ΔP (Penurunan Tekanan Uap Jenuh)
Keterangan :
- ΔP = tekanan uap jenuh
- P° = tekanan uap pelarut murni
- X† = fraksi mol zat pelarut
- i = faktor van’t hoff
-
Kenaikan Titik Didih
Keterangan :
- ΔTb = kenaikan titik didih
- Kb = ketetapan kenaikan titik didih
- m = molalitas larutan
- i = faktor van’t hoff
-
Penurunan Titik Beku
Keterangan :
- ΔTf = penurunan titik beku
- Kf = tetapan penurunan titik beku
- m = molalitas larutan
- i = faktor van’t hoff
-
Tekanan Osmosis Larutan
Keterangan :
- ∏ = tekanan osmosis larutan
- M = molaritas
- R = tetapan gas
- T = suhu mutlak
- i = faktor van’t hoff
Rumus Koligatif Larutan Non Elektrolit
-
Penurunan Tekanan Uap Jenuh
Keterangan :
- ΔP = Penurunan tekanan uap jenuh
- P° = Tekanan uap pelarut murni
- XA =Fraksi mol zat pelarut
- XB = Fraksi mol pelarut
-
Kenaikan Titik Didih
Keteragan :
- ΔTb = kenaikan titik didih
- Kb = ketetapan kenaikan titik didih
- m = molalitas larutan
-
Penurunan Titik Beku
Keterangan :
- ΔTf = penurunan titik beku
- Kf = tetapan penurunan titik beku
- m = molalitas
-
Tekanan Osmosis
Keterangan :
- ∏ = tekanan osmosis larutan
- M = molaritas
- R = tetapan gas
- T = suhu mutlak
Contoh Soal Sifat Koligatif dan Jawaban
Berikut dibawah ini contoh soal dan jawabannya :
- Jika pada suatu tekanan osmotik berjumlah 500 ml larutan fruktosa, C6H12O6 dari suhu 32°C sebesar 2 atm, maka jumlah massa fruktosa yang dilarutkan adalah :
a. 7,2 gram
b. 9,0 gram
c. 14,4 gram
d. 18,0 gram
e. 45,0 gram

- Pada fraksi mol larutan urea didalam air 0,2. Tekanan uap pada jenuh air murni dengan suhu 20°C sebanyak 17,5 mmHg. Maka tekanan uap jenuh larutan pada suhu berikut yaitu :
a. 16 mmHg
b. 15 mmHg
c. 14 mmHg
d. 13 mmHg
e. 12 mmHg

- Penambahan 5,4 g pada suatu zat nonelektrolit didalam 300 g air ternyata akan menurunkan titik beku sebesar 0,24°C. Lalu Kf air = 1,86 °C/molal, maka Mr zat tersebut yaitu :
a. 8,04
b. 12,56
c. 60,96
d. 108,56
e. 139,50
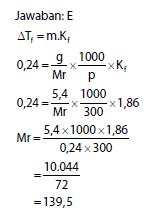
Demikianlah artikel dari pengajar.co.id Sifat Koligatif Larutan : Pengertian, Rumus, Contoh Soal, semoga dengan adanya artikel bisa bermanfaat dan lebih menambah wawasan anda.