Teori Atom Rutherford: Awal Revolusi Besar dalam Memahami Struktur Atom Dunia sains modern tidak bisa dilepaskan dari sejarah panjang penemuan tentang atom — partikel terkecil yang menjadi dasar dari seluruh materi di alam semesta. Salah satu titik penting dalam perjalanan itu adalah munculnya teori atom Rutherford, yang mengubah secara drastis pandangan ilmuwan tentang bagaimana atom sebenarnya tersusun.
Sebelum teori ini muncul, dunia masih berpegang pada konsep yang dikembangkan oleh J.J. Thomson melalui model “roti kismis” atau plum pudding model, di mana elektron dianggap tersebar merata dalam bola bermuatan positif. Namun eksperimen yang dilakukan oleh Ernest Rutherford pada awal abad ke-20 mengguncang pandangan itu dan membuka babak baru dalam fisika modern.
“Ketika Rutherford menembakkan partikel alfa ke lempengan emas, dunia sains seolah menemukan peta baru tentang isi semesta.”
Siapa Ernest Rutherford: Bapak Fisika Nuklir
Ernest Rutherford lahir di Selandia Baru pada tahun 1871 dan dikenal sebagai salah satu ilmuwan paling berpengaruh dalam sejarah fisika. Ia adalah sosok yang tak hanya menemukan struktur atom, tetapi juga memelopori penelitian tentang radioaktivitas dan reaksi inti atom.
Rutherford dikenal sebagai ilmuwan yang teliti, ulet, dan tak mudah percaya pada teori yang belum terbukti. Setelah bekerja dengan J.J. Thomson di Universitas Cambridge, ia kemudian melakukan penelitian mandiri di Universitas Manchester yang berujung pada penemuan luar biasa tentang struktur atom.
Dalam eksperimen terkenalnya pada tahun 1911, Rutherford bersama dua asistennya — Hans Geiger dan Ernest Marsden — menemukan fakta yang membantah model atom sebelumnya. Dari sanalah lahir apa yang kini dikenal sebagai Teori Atom Rutherford, fondasi penting yang melahirkan pemahaman modern tentang inti atom dan partikel subatom.
“Rutherford bukan hanya menemukan struktur atom, tetapi juga menyalakan api pengetahuan yang membakar rasa ingin tahu generasi ilmuwan setelahnya.”
Latar Belakang Munculnya Teori Atom Rutherford
Sebelum Rutherford, model atom yang paling dikenal adalah model Thomson. Dalam teori itu, atom digambarkan seperti bola bermuatan positif dengan elektron tersebar di dalamnya, layaknya kismis dalam roti. Model ini diterima luas karena mampu menjelaskan beberapa fenomena listrik.
Namun, Rutherford merasa teori tersebut tidak cukup menjawab bagaimana partikel bermuatan positif dan negatif dapat stabil dalam satu sistem tanpa saling menetralkan. Ia kemudian melakukan eksperimen hamburan partikel alfa untuk membuktikan struktur sebenarnya dari atom.
Eksperimen ini menjadi salah satu percobaan paling terkenal dalam sejarah sains. Ia menggunakan sumber radioaktif yang memancarkan partikel alfa (inti helium bermuatan positif) dan menembakkannya ke lembaran tipis emas. Di sekelilingnya, ia menempatkan layar fluoresen yang bisa mendeteksi partikel alfa yang memantul.
Eksperimen Lembaran Emas: Momen yang Mengubah Dunia
Hasil eksperimen tersebut benar-benar mengejutkan. Sebagian besar partikel alfa memang menembus lempengan emas tanpa pembelokan, tetapi sebagian kecil mengalami pembelokan tajam, bahkan ada yang memantul ke arah sumber.
Temuan itu mustahil dijelaskan dengan model Thomson, karena jika muatan positif tersebar merata, maka partikel alfa seharusnya tidak pernah memantul.
Rutherford kemudian menyimpulkan bahwa muatan positif dalam atom tidak tersebar, tetapi terkonsentrasi di suatu titik kecil di pusat atom, yang kemudian dikenal sebagai inti atom (nukleus).
Dari hasil itu, ia menyusun model atom baru yang dikenal sebagai Model Atom Rutherford pada tahun 1911.
“Melalui partikel alfa yang memantul, Rutherford menemukan bahwa di balik ruang kosong atom, ada pusat kekuatan yang luar biasa.”
Konsep Utama dalam Teori Atom Rutherford
Teori ini menjelaskan struktur atom dengan konsep revolusioner yang berbeda jauh dari model sebelumnya. Berikut adalah inti dari teori yang dikemukakan Rutherford:
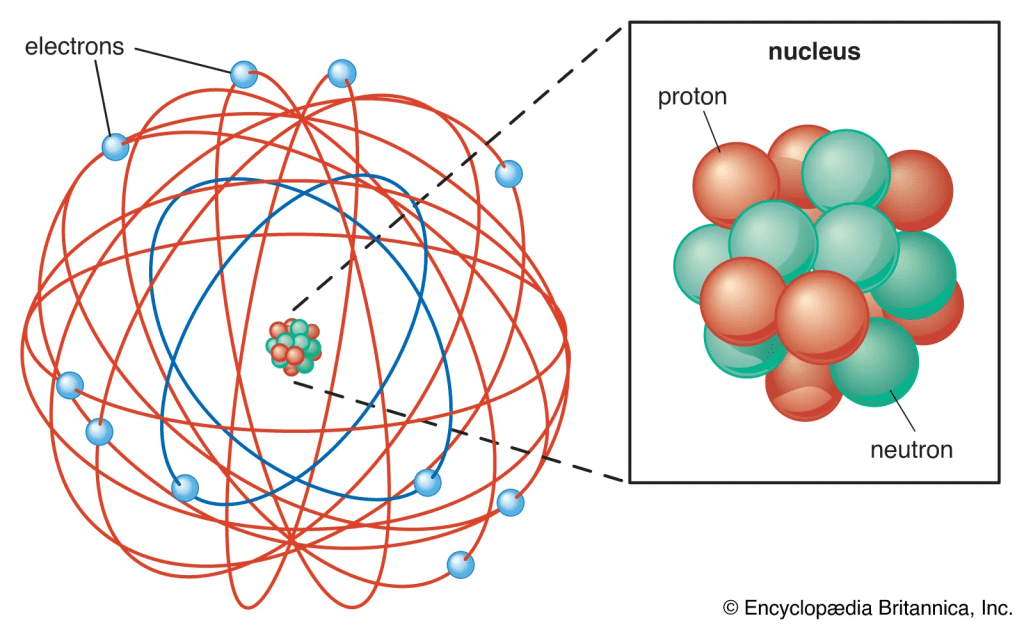
- Atom Terdiri dari Inti dan Elektron
Atom memiliki inti kecil di pusat yang bermuatan positif, dikelilingi oleh elektron yang bergerak mengelilinginya. - Inti Atom Bermuatan Positif dan Padat
Massa atom sebagian besar terkonsentrasi di inti. Inilah alasan mengapa partikel alfa dapat memantul ketika bertabrakan dengan inti atom. - Elektron Mengelilingi Inti dalam Ruang Kosong
Sebagian besar volume atom adalah ruang kosong, karena jarak antara inti dan elektron sangat jauh. - Atom Bersifat Netral Secara Listrik
Jumlah muatan positif pada inti seimbang dengan jumlah muatan negatif elektron, sehingga atom bersifat netral.
“Teori Rutherford mengajarkan bahwa sesuatu yang tampak padat sejatinya lebih banyak berisi ruang kosong — bahkan pada tingkat terkecil dari materi.”
Gambaran Struktur Atom Rutherford
Dalam model Rutherford, atom digambarkan mirip seperti tata surya. Inti atom berperan sebagai “matahari”, sementara elektron berputar mengelilinginya layaknya planet yang mengorbit.
Perumpamaan ini membuat konsep atom lebih mudah dipahami dan sekaligus menjelaskan bagaimana partikel bermuatan negatif tidak jatuh ke inti, karena memiliki gaya sentripetal akibat pergerakannya yang cepat.
Namun, model ini masih memiliki kelemahan — sesuatu yang kelak disempurnakan oleh Niels Bohr. Tapi sebelum masuk ke kelemahan, penting untuk memahami dulu keunggulan yang membuat teori Rutherford tetap dianggap monumental dalam sejarah fisika.
Kelebihan Teori Atom Rutherford
Munculnya teori ini bukan sekadar menggantikan model lama, tetapi juga memperluas cakrawala pemahaman ilmiah tentang struktur atom. Beberapa kelebihan teori atom Rutherford antara lain:
- Menemukan Keberadaan Inti Atom
Ini adalah sumbangan terbesar dari Rutherford. Penemuan inti menjadi dasar bagi pengembangan teori atom modern dan penelitian nuklir. - Menjelaskan Ruang Kosong dalam Atom
Sebelumnya, ilmuwan menganggap atom padat. Rutherford membuktikan bahwa sebagian besar atom sebenarnya kosong, dengan inti kecil di tengah. - Menjelaskan Distribusi Muatan dalam Atom
Muatan positif terkonsentrasi di inti, sementara elektron bermuatan negatif bergerak di sekitarnya. Hal ini menjelaskan kestabilan listrik atom. - Menjadi Dasar Teori Atom Modern
Semua model setelahnya, termasuk model Bohr dan model mekanika kuantum, dikembangkan dari konsep dasar Rutherford. - Membuka Jalan bagi Fisika Nuklir
Penemuan inti atom menjadi pijakan bagi penelitian reaksi nuklir, radioaktivitas, dan bahkan pengembangan energi atom.
“Kelebihan teori Rutherford bukan hanya karena akurasinya, tetapi karena keberaniannya menggugat cara lama manusia memandang materi.”
Kelemahan dan Keterbatasan Teori Rutherford
Meski revolusioner, teori ini tidak lepas dari kritik dan keterbatasan. Salah satu kelemahan paling mendasar adalah bahwa teori Rutherford tidak bisa menjelaskan kestabilan atom.
Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti akan memancarkan energi elektromagnetik secara terus-menerus, sehingga lama-kelamaan energinya habis dan elektron akan jatuh ke inti. Jika itu benar, atom seharusnya tidak stabil — padahal kenyataannya atom stabil.
Selain itu, model Rutherford juga tidak dapat menjelaskan spektra garis pada atom hidrogen, yaitu warna cahaya spesifik yang dipancarkan oleh atom saat tereksitasi.
Masalah inilah yang kemudian disempurnakan oleh Niels Bohr pada tahun 1913 dengan teorinya yang lebih kuantitatif dan menjelaskan orbit elektron secara teratur berdasarkan tingkat energi tertentu.
“Keterbatasan bukan berarti kegagalan; dalam sains, setiap kekurangan adalah pintu menuju penemuan baru.”
Eksperimen dan Bukti Fisik dari Teori Rutherford
Hasil eksperimen Rutherford tidak hanya menjadi teori, tapi juga bukti nyata yang bisa diuji berulang kali. Dengan menggunakan partikel alfa yang ditembakkan ke logam emas setebal 0,00004 cm, ia menemukan fakta sebagai berikut:
- Sebagian besar partikel alfa menembus tanpa pembelokan — menunjukkan bahwa sebagian besar ruang dalam atom kosong.
- Beberapa partikel mengalami pembelokan kecil — karena mendekati inti yang bermuatan positif.
- Sangat sedikit partikel memantul balik — karena bertumbukan langsung dengan inti atom yang sangat padat.
Dari data tersebut, ia menghitung bahwa inti atom memiliki diameter sekitar 1/10.000 ukuran atom, yang artinya inti sangat kecil namun memiliki massa yang hampir seluruhnya dari atom.
Penemuan ini mengubah arah penelitian fisika dan kimia. Untuk pertama kalinya, manusia memahami bahwa atom bukan bongkahan padat, tetapi struktur yang memiliki ruang dan pusat energi besar di tengahnya.
“Satu percobaan sederhana mampu mengubah pandangan manusia tentang alam semesta lebih dalam daripada ribuan teori abstrak.”
Pengaruh Teori Rutherford terhadap Perkembangan Ilmu
Tidak berlebihan jika dikatakan bahwa tanpa teori Rutherford, sains modern tidak akan mencapai bentuknya seperti sekarang. Penemuan tentang inti atom menjadi dasar bagi banyak perkembangan besar di abad ke-20.
- Lahirnya Teori Bohr dan Mekanika Kuantum
Niels Bohr mengembangkan model orbit elektron berdasarkan teori Rutherford dan teori kuantum Planck. - Penemuan Proton dan Neutron
Rutherford sendiri pada tahun 1919 menemukan proton, sedangkan James Chadwick menemukan neutron pada tahun 1932. - Perkembangan Energi Nuklir dan Reaktor Atom
Konsep inti atom mengarah pada penelitian reaksi inti, yang menjadi dasar bagi pembangkit listrik tenaga nuklir dan juga senjata atom. - Pemahaman Baru tentang Radioaktivitas
Rutherford memperluas penelitian tentang peluruhan radioaktif dan memberikan pemahaman baru tentang umur unsur kimia. - Perkembangan Teknologi Medis dan Industri
Dari hasil penelitian atomik, lahirlah berbagai aplikasi seperti terapi radiasi, pemindaian medis, hingga deteksi logam berat.
“Rutherford tidak hanya mengubah ilmu, tapi juga mengubah arah sejarah manusia — dari sekadar memahami atom, menjadi mampu memecahkannya.”
Model Atom Rutherford dalam Kehidupan Modern
Walau model ini telah diperbarui oleh teori kuantum modern, prinsip dasar Rutherford masih digunakan dalam berbagai bidang pendidikan dan riset. Model ini diajarkan di sekolah menengah hingga universitas karena memberikan gambaran visual yang mudah dipahami tentang struktur atom.
Selain itu, teori Rutherford juga menjadi dasar dalam alat seperti pemindai partikel, akselerator nuklir, dan mikroskop elektron yang memungkinkan ilmuwan meneliti dunia mikro hingga tingkat subatomik.
Bahkan dalam konteks sosial, model ini memberi inspirasi filosofis: bahwa di balik segala sesuatu yang tampak padat dan stabil, selalu ada ruang kosong dan inti kekuatan yang tak terlihat — seperti manusia dengan pikirannya.
“Atom adalah cerminan kehidupan: kecil, kompleks, dan menyimpan kekuatan besar di pusatnya.”







